研究内容
Gene Regulation: Understanding the Principle, Engineering the System, and Evolving the Medicine.
研究室概要
当研究室は、ゲノムとRNAの作動原理の詳細を明らかにし、その精度の高い理解に基づいて、がんのメカニズムを明らかにし新たな治療法を見出すことを目指しています。遺伝子がどのように機能するのか?この基本的な問いは、遺伝子と環境の相互作用によっておきる「がん」などの多くの疾病のメカニズムを理解する上で非常に重要です。当研究室では、次世代シーケンサー・バイオインフォマティクス・ゲノム編集などの技術躍進に基づく大規模データ群の統合的解析を通じて、ゲノム・エピゲノム・転写・RNAネットワークの関係性を丹念に読み解き、遺伝子制御の作動原理や疾患のメカニズムを探索する幅広い研究を推進しています。さらに、大規模データ群の統合的解析を通じて得られた包括的生命情報を基盤として、「ゲノムの病気」であるがんに対する新たなプレシジョン医療の基本コンセプトを創出すること、そして、これを可能にする新たな方法論・技術を構築することを目標にしています。
研究内容
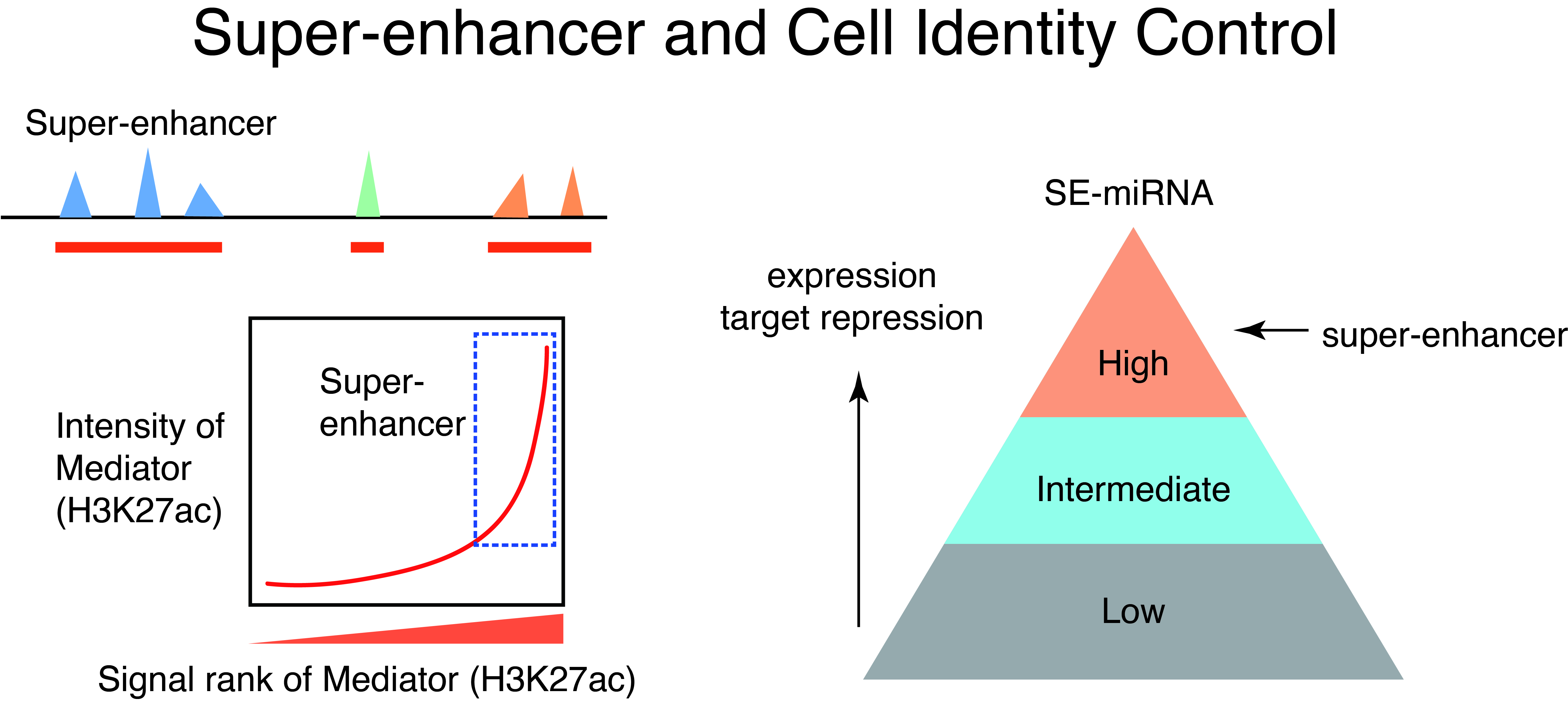
1. ゲノム相分離生物学:スーパーエンハンサーと相分離
私たちの体を構成するさまざまな細胞が、同一のゲノム情報から異なる種類の細胞のアイデンティティーをどのように確立しているかは、私たちの生体を制御する遺伝子発現プログラムを理解する上で中心的な課題です。細胞種特異的なエンハンサーによる遺伝子制御は、細胞のアイデンティティーの決定において中心的な役割を果たしますが、近年、細胞種特異的な転写因子の結合領域が局所的に密集するゲノム領域であるスーパーエンハンサーが注目を集めています。私たちは、RNAに注目することで、スーパーエンハンサーの機能について研究を進めてきました。これまでに、スーパーエンハンサーとマイクロRNAの関係に注目し、細胞種特異的かつ進化的に保存されたマスターマイクロRNAによるRNA制御ネットワークが形作られる上で、スーパーエンハンサーが中心的な役割を持つことを定量的に明らかにし、スーパーエンハンサーコンセプトの妥当性を検証してきました(Suzuki et al, Cell, 2017)。また、この報告では、スーパーエンハンサーが転写だけでなく、RNAプロセシングのプラットフォームとして機能していることも見出しました。
近年、細胞内の膜を持たない構造体(非膜性構造体)の作動原理として液-液相分離(liquid-liquid phase separation, LLPS)が注目されており、液-液相分離および液-液相分離によって形成される細胞内構造体、すなわち、生体分子凝集体(biomolecular condensate)が遺伝子制御・シグナル伝達などのさまざまな細胞プロセスで重要な役割を持っていることが明らかになってきています。スーパーエンハンサーに関するさまざまな研究から、現在、スーパーエンハンサー領域に、転写因子やMediatorなどの転写調節因子が液-液相分離で集積することにより強力な転写活性化が誘導されるというモデルが提案されています(Suzuki et al, Cancer Science, 2022)。現在、われわれは、細胞内相分離のドライバーである天然変性領域の網羅的データ解析や新しい技術開発を通じて、細胞内相分離とゲノム・転写制御の関係の探索、および、疾患研究への展開を進めています。また、機械学習を用いたスーパーエンハンサーの機能を解析する研究も進めています。
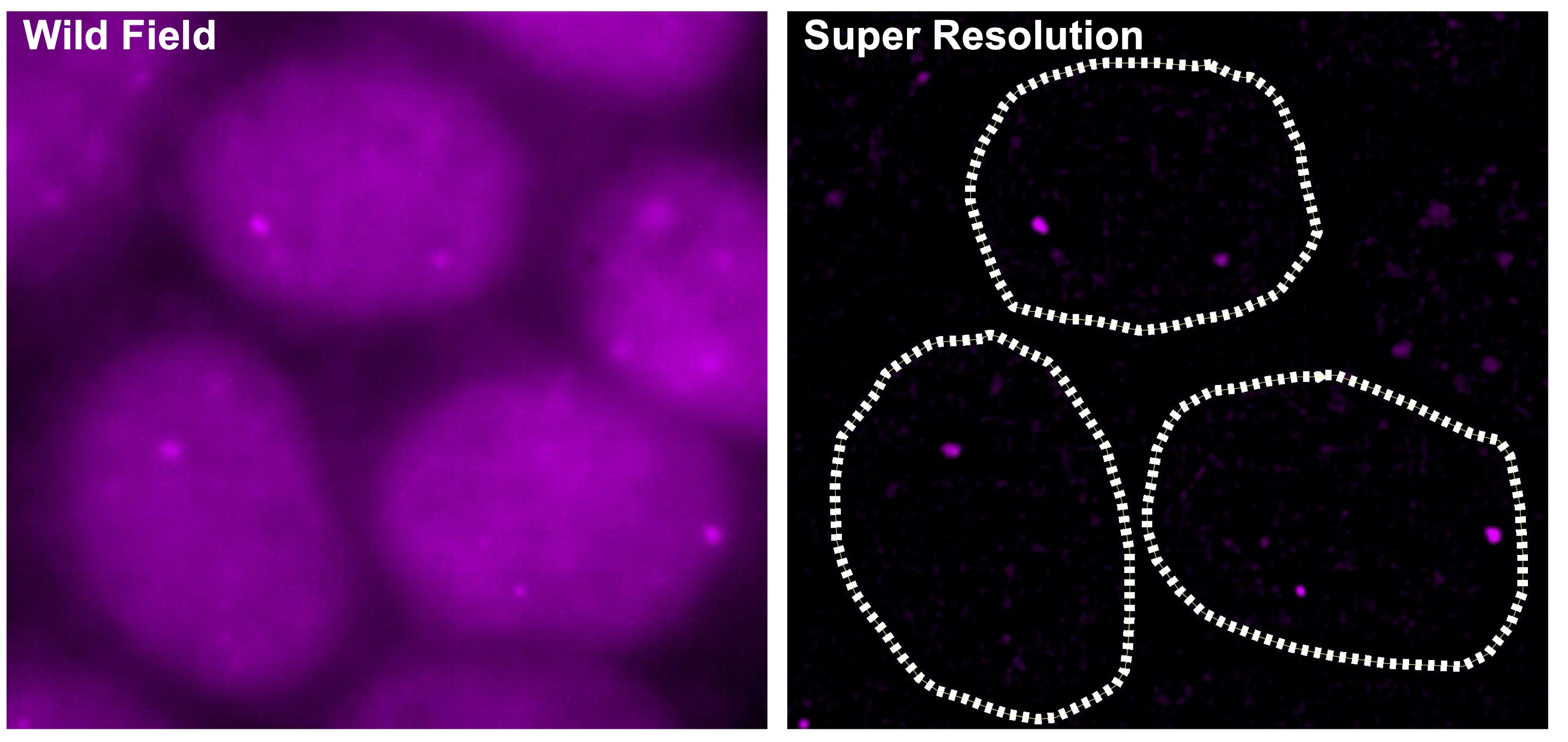
2. あきらめないがん治療へ:染色体外環状DNAを標的とした次世代がん治療
スーパーエンハンサーはがん細胞の転写制御においても非常に重要な役割をもちます。これまでに、正常細胞・組織とがん細胞のスーパーエンハンサーの比較から、マイクロRNA遺伝子の近傍のスーパーエンハンサーに大きな変化がおき、がん細胞では、がん抑制的なマイクロRNAに関連したスーパーエンハンサーの喪失、がん促進的なマイクロRNAに関連したスーパーエンハンサーの形成がみられることを見出しています(Suzuki et al, Cell, 2017)。また、マイクロRNAの機能獲得型変異による初のヒト疾患の同定と関連して(Grigelioniene et al, Nature Medicine, 2019)、がん研究における機能ゲノミクスのビッグデータ解析の新しい方向性も報告しています(Suzuki et al, Nature Genetics, 2018)。スーパーエンハンサーによる転写制御に関与する分子群であるBRD4やCDK7の阻害剤のがん治療への応用が検討されていますが、一方で、正常細胞でもスーパーエンハンサーは当然機能しており、このような治療法の選択性・特異性が問題となっています。最近、われわれは、がん細胞に対してより特異的な転写標的治療法を開発するために、染色体外環状DNA(extrachromosomal circular DNA, eccDNA)に注目して研究を進めています。
がんでは、染色体転座・増幅・変異によるエンハンサー・スーパーエンハンサーの異常が起き、前述のスーパーエンハンサーを標的とした治療法もその対象として染色体内のエンハンサーを想定しています。一方、がんでは、二重微小染色体(Double Minute, DM)と呼ばれる染色体外DNAの存在が1980年頃より報告されてきましたが、2017年ごろより、染色体外で環状になったDNA(染色体外環状DNA, extrachromosomal circular DNA, eccDNA)ががん細胞で広範に存在することが報告され、徐々に注目を集めています。eccDNAにはがん遺伝子と(スーパー)エンハンサーが含まれ、染色体内より転写活性が強く、正常細胞ではみられないこととあわせて、より選択的な転写標的治療法の標的となると考えられます。また、eccDNAを有する症例は予後不良であることが報告されており、eccDNAは、がんの進化(悪性度の促進)、がん細胞の不均一性、および、不均一性に関連した薬剤耐性の獲得に寄与することが提案されています。がんと治療のいたちごっこはがん治療の永遠の課題でもあり、eccDNAを標的とするようながん治療はまだ開発されていません。現在、われわれは、eccDNAを標的としたより特異性の高い転写標的治療法を開発中です。
3. RNAの多様性からみた転写の生物学

細胞のアイデンティティーを規定するエンハンサーの機能を理解するためには、エンハンサー自身でおきる転写(RNA産生)、また、エンハンサーが制御するプロモーターの転写の動態の詳細を理解することが重要です。多くのエンハンサー・プロモーターは双方向性の転写を誘導し、双方向に転写産物(RNA)を産生しています(divergent transcription)。転写を担うRNAポリメラーゼIIは、コード領域で、単純に、転写開始点からオン・オフのようにmRNAを産生しているのではなく、転写の開始・転写の一時休止(ポージング)・転写の伸長などの多段階のステップの制御を経て(転写サイクル)、最終的に機能するmRNAを産生しています。私たちは、ゲノム科学・情報科学の視点を積極的に導入することで、転写サイクルの詳細の理解を進めています。
タンパク質をコードする遺伝子はゲノム上で非常に長く分布しており、多くのプロモーターは、タンパクをコードする方向には転写が長く伸長し、逆のアンチセンス方向には早く終結する特徴を持っています。この特徴は、ゲノム上のスプライシングモチーフ (U1モチーフ) とポリアデニル化シグナル (PASモチーフ) の両方向での不均等な分布によって調節されており(U1-PAS axis)、アンチセンス側ではPASモチーフの高頻度の分布により転写の早期終結が惹起されます。私たちは、これまでに、PASモチーフにより同様の転写の早期終結がセンス側でも広範囲に起きており、この早期終結サイトとRNAポリメラーゼII (Pol II) の転写ポージングサイトがゲノム上で共局在していることを見出しています(Chiu et al, Mol Cell, 2018)。この早期終結サイト・Pol II新規転写ポージングサイトは従来知られている転写開始点直下のPol II転写ポージングサイトとは異なることを明らかにしています。
近年の大規模ながんゲノム解析の進展により、RNAスプライシング因子などの、転写やRNAプロセシングに関係する分子群の異常が新たに明らかになってきました。これらの異常の機能的意義の検証は十分にされていないことが多く、転写・RNAプロセシングの詳細の理解はがんにおける異常の理解においても重要と考えられます。急性骨髄性白血病や骨髄異形成症候群ではエンハンサーとプロモーターの相互作用に関与するコヒーシン遺伝子の変異が高頻度でみられます。最近、私たちは、京都大学との共同研究により、(1)コヒーシン遺伝子の変異が転写因子の変異と協調的にゲノムの3次元構造(ループ)の異常を引き起こし骨髄異形成症候群を誘導すること、(2)コヒーシン遺伝子の変異が、広範なゲノムの3次元構造への影響とは対照的に、転写ポージングの程度が高い遺伝子群の選択的な発現低下を引き起こすことを報告しています(Ochi et al, Cancer Discovery, 2020)。
現在、われわれは、スーパーエンハンサー(ゲノム非コード領域)・RNA修飾・RNAの転写終結機構などに注目して、新しい転写制御のメカニズムの探索、および、がん研究への展開を進めています。
4. 多階層オミクス解析やシングルセル解析を駆使した疾患研究

当研究室では、これまでに、次世代シーケンサーを用いた大規模データ群の統合的解析を通じて、疾患のメカニズムを探索する幅広い研究を推進してきました。特に、マイクロRNA、エピジェネティクス、スーパーエンハンサー、転写制御などに関する解析について長年の経験を有します。現在、これらの多階層オミクス解析に加えて、シングルセル解析を統合することにより、がんだけでなく様々な疾患の病態解析を進めています。
5. マイクロRNAとがん
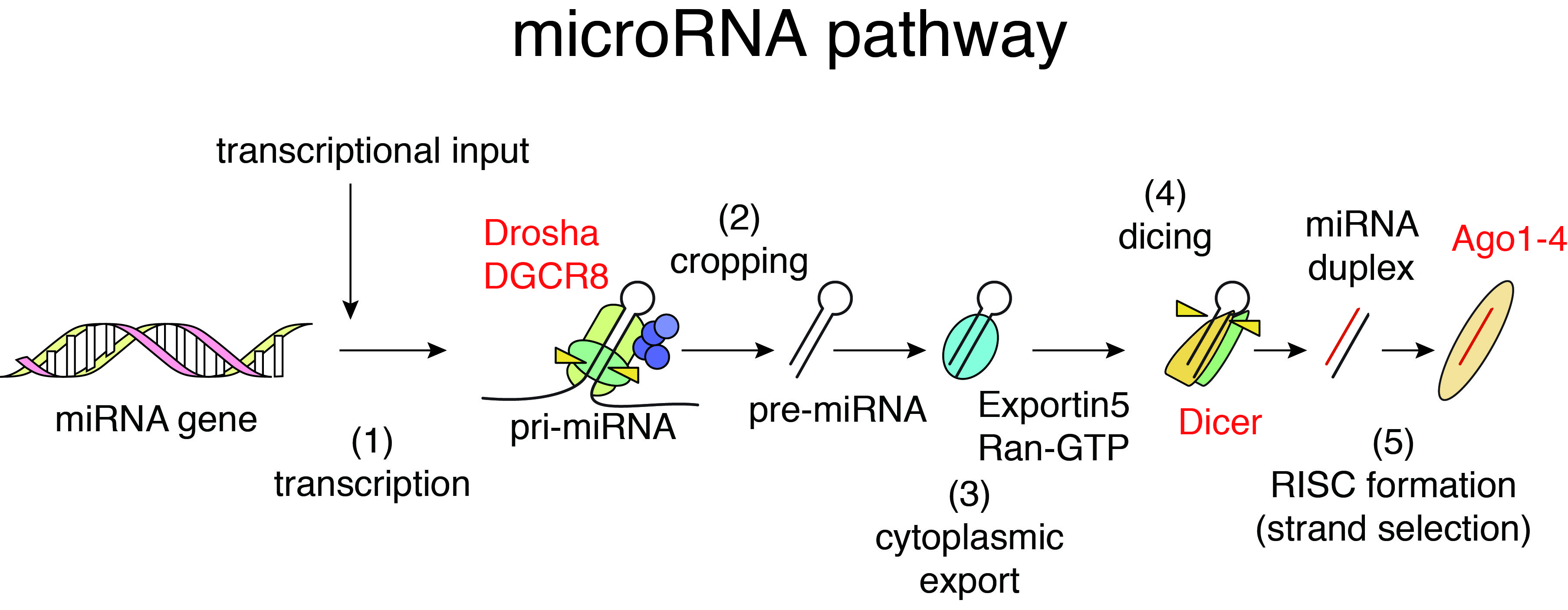
多くの遺伝子は、DNAからRNAがつくられ、RNAからタンパク質がつくられる、というセントラルドグマに沿って、機能しています。一方で、タンパク質をコードするゲノム領域以外の広範なゲノム領域で転写がおき、タンパク質へと翻訳されない多数のRNA(ノンコーディングRNA)が産生されていることが知られています。マイクロRNAは、そのようなノンコーディングRNAの代表の1つで、21~25塩基程度の低分子RNAです。マイクロRNAの存在は1993年に報告されていましたが、1998年のFire,MelloらによるRNA干渉の報告を起点として、同様の分子の検索が促され分野の研究が飛躍的に進んできました。
哺乳類細胞では、マイクロRNAは、マイクロRNAの前駆体を含む長いRNAがDrosha、DicerといったRNA切断酵素によって短く切断され、最終的に、小さなRNAがArgonaute(Ago)とよばれるタンパク質と複合体を形成することで機能します。Agoと結合したマイクロRNAは、シード配列と呼ばれる5’末端の7-8塩基に対して相補的塩基配列をもった標的mRNA(主に3’UTR領域)に結合し、遺伝子発現を主に抑制します。マイクロRNAによる標的mRNAの認識は配列特異的ですがシード配列がきわめて短いため、マイクロRNAと標的mRNAの対応は「多対多」であり、複雑な制御ネットワークを形成していると考えられています。マイクロRNAは正常の細胞の調節だけでなく、がんなどの様々な疾患に関係していることが知られています。私たちはこれまでにがんと、マイクロRNAの細胞内合成機構・遺伝子調節ネットワークの関係に注目し、がん抑制因子p53がマイクロRNAの細胞内での生合成を制御することなどを発見し、マイクロRNAの生合成のダイナミズムの一端を明らかにしてきました(Suzuki et al, Nature, 2009; Suzuki et al, Mol Cell, 2011)。
マイクロRNAは、多くの研究で、細胞増殖、細胞死、転移能といったがん細胞の特性そのものに影響を与えることが報告されてきました(細胞自律的な機能)。一方で、私たちは、マイクロRNAが悪性リンパ腫細胞の免疫形質を調節することで周囲のがん微小環境に影響を与えることを報告し、がんにおける細胞非自律的な機能の重要性を見出してきました(Matsuyama et al, Blood, 2011; Suzuki et al, Oncogene, 2015)。
6. システムRNA生物学:RNAやゲノムの機能を数式やコンピュータで記述可能か
マイクロRNAは多くの標的mRNAを調節し、また、マイクロRNAやノンコーディングRNAが遺伝子制御に与える影響は全体的に弱いことが多く、このような複雑系をシステムとして理解するためにはゲノムワイドデータを俯瞰的に解析する新しい方法論の構築が重要です。これまでに、マイクロRNA・mRNAの発現の統合解析に基づく新規解析手法を開発し、この手法によってがんなどのより頑健なバイオマーカーをゲノムワイド発現解析から抽出できる可能性を明らかにしてきました(Suzuki et al, Nucleic Acid Res, 2013; Suzuki et al, Leukemia, 2013)。
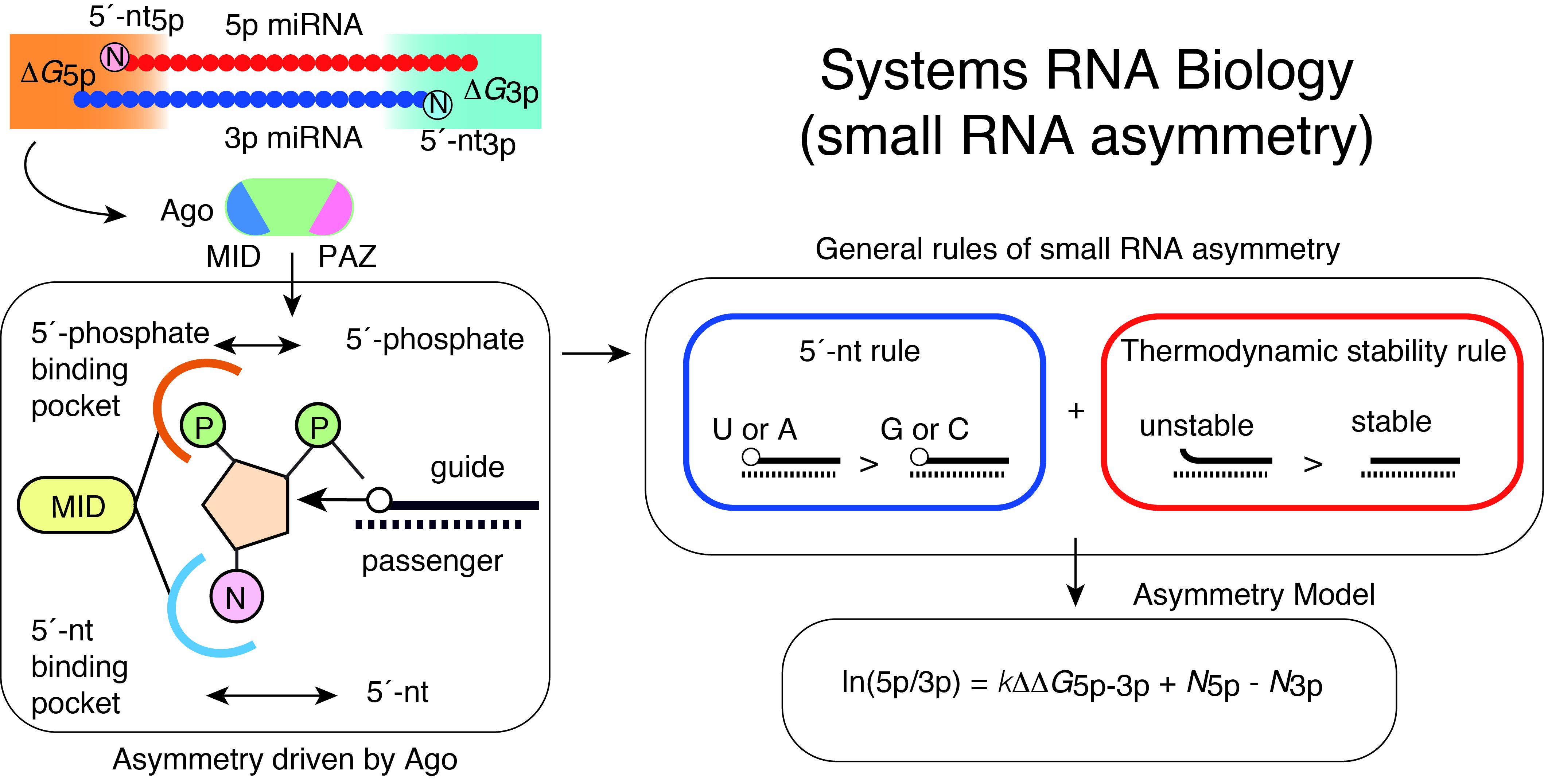
また、マイクロRNAの産生およびRNA干渉において、その起点となる二本鎖RNAからどちらのRNA鎖が機能するガイド鎖として選択されるのかは、マイクロRNAによる遺伝子制御・RNA干渉の特異性の調節において重要な問題です。この問題について、私たちは、分子生物学、生物物理学、構造生物学、バイオインフォマティクスなどを統合し、マイクロRNAの非対称性の一般的な原理、および、これに対応する分子機構を解明し、さらに、対応する数理モデルを構築することに成功してきました(Suzuki et al, Nat Struct Mol Biol, 2015; Matsuyama et al, IJMS, 2019)。特に、数理モデルの構築により、次世代シーケンサーで測定されるマイクロRNAの発現量の比を数式で予測することが可能になりました。がんでみられるマイクロRNAの変異に伴う機能の異常が、この数理モデルで説明できることも示しています。この理論的な枠組みにより、合成生物学におけるRNA回路のシミュレーションが可能となり、合成生物学をがん免疫療法に応用可能であることを見出しています(Nissim et al, Cell, 2017)。また、このモデルはマイクロRNAの機能獲得型変異による初のヒト疾患の同定の一助ともなっています(Grigelioniene et al, Nature Medicine, 2019)。
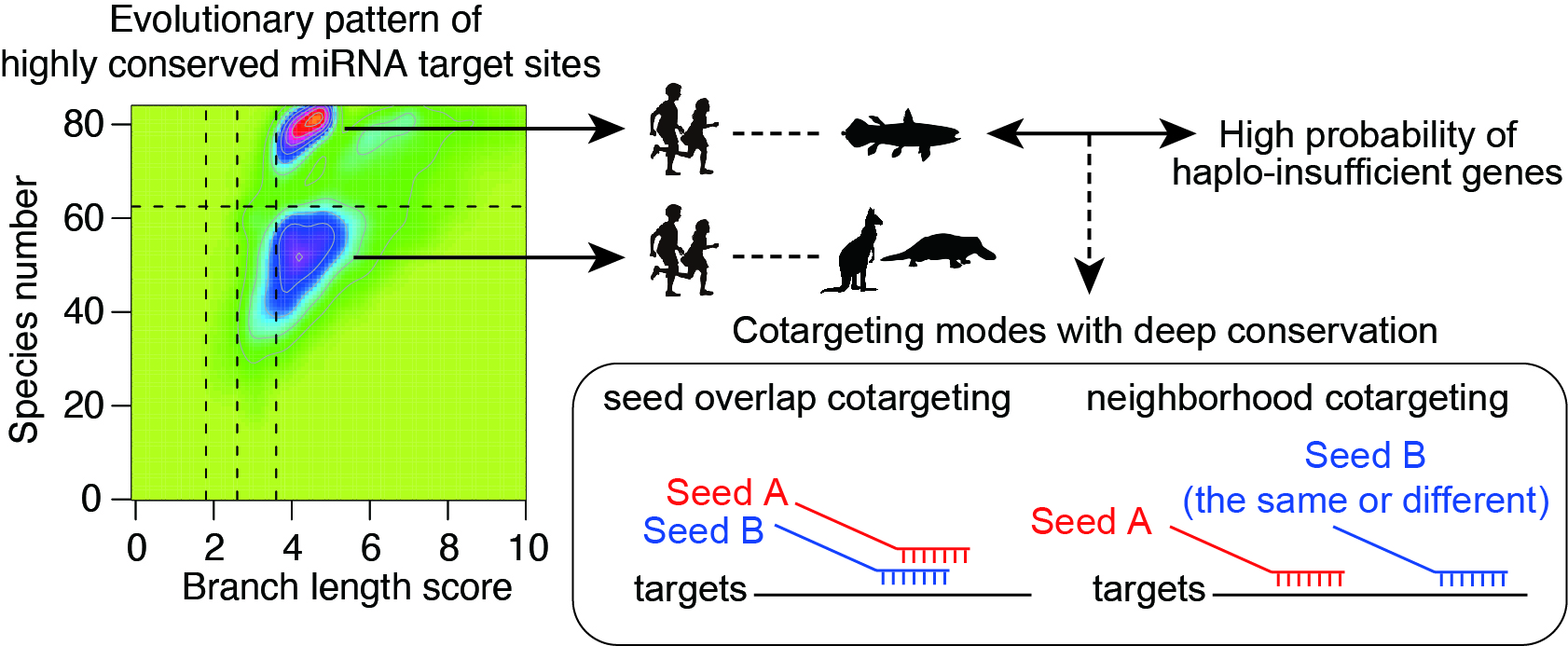
多様な疾患で、複数のマイクロRNAの発現が異常を示すことが多く報告されています。一般的に、1つのマイクロRNAが標的遺伝子を抑制する効果は小さく、2つ以上のマイクロRNAが同じ標的遺伝子に結合することで協調的あるいは付加的に遺伝子を抑制することが重要です。最近の研究では、疾患における複数(2つ)のマイクロRNAの発現異常に注目し、統合的バイオインフォマティクスを通じて、2つのマイクロRNAが働く仕組みの多様性と、進化的変遷の特徴を明らかにしています(Kitai et al, BMC Biology, 2022)。
7. RNA干渉やCRISPR/Cas9に続く新たな遺伝情報・ゲノム制御技術の開発

私たちは、自分たちで実施する分子生物学的方法論・アイデアに対して、臨機応変に最適なゲノムワイドデータ解析・シミュレーションを自ら構築し仮説を検証する、そして、その相互フィードバックで新しい発見をして研究を発展させてゆくという研究スタイルを構築しています。最近では、九州大学との共同研究で大規模実験データ解析と数理シミュレーションを統合することにより、CRISPR-Cas9システムのゲノム切断活性を自在に微調整できる新技術を開発し、Cas9の過剰な活性の抑制を通じて安全性と正確な編集の効率を数百倍オーダーで高めることができる次世代型のゲノム編集プラットフォームの開発に成功しています(Kawamata et al, Nature Biomedical Engineering, 2023)。このような研究スタイルを発展させることで、新しい挑戦をしていきたいと考えています。